CENTRO
DE BACHILLERATO TECNOLOGICO
“LIC.
JULIAN DIAZ ARIAS”
MATERIA:
SUBMODULO II.
CALCULA LAS CANTIDADES
OBTENIDAS DE UN ANÁLISIS GRAVIMETRICO DE UNA DETERMINADA MUESTRA
INTEGRANTES
DEL EQUIPO:
LUIS
ENRIQUE ANGEL GONZALEZ
KATIA
DEL CARMEN CASTRO PÉREZ
JESSICA
MISHEL LUNA ROLDAN
ALDO
ORTEGA VALLES
VICTOR
FRUCTUOSO PICHARDO TOLA
ISAI
REYES HERNÁNDEZ
GRADO:
3º
GRUPO: “3”
CARRERA:
TÉCNICO
LABORATORISTA QUÍMICO
MARCO TEÓRICO
Determinación
del Índice de Peróxidos. (Método volumétrico)
Se define como los
miliequivalentes (mEq) de peróxido por kilogramo de grasa. Es unadeterminación
volumétrica de la cantidad de grupos peróxidos e hidroperóxidos.
Lacuantificación se basa en la reacción del yoduro de potasio con los peróxidos
paraliberar yodo, el cual es titulado con tiosulfato de sodio, empleando
almidón comoindicador (Nielsen, 1998).
Determinación
de peróxidos. Método volumétrico-Micrométodo.
Tiene el mismo principio que
el método volumétrico descrito en el AOAC, espropuesto por Crowe y White en
2001, donde demuestran que tiene una relación lineal(r2= 0.998) además de
sensibilidad y precisión adecuadas empleando solo el 10% de losreactivos
químicos necesarios para el método oficial.
Determinación
de Índice de Peróxidos (Método colorimétrico)
Este es un método colorimétrico
indirecto. Se basa en que a una muestra quecontenga peróxidos se adiciona un
reactivo de hierro (II); en la muestra se llevará a cabola oxidación
electroquímica de hierro (II) a hierro (III) (Jianget al, 1992)y éste último
serácuantificado por su reacción de complejación con tiocianato mostrando un
color rojocaracterístico.(Kirk, 1991).
PRACTICA NO. 2 DETERMINACIÓN
DE PERÓXIDOS EN DIFERENTES MUESTRAS DE AGUA OXIGENADA E HIDRÓXIDO DE AMONIO.
COMPETENCIA:
Al término de la práctica el alumno obtendrá el conocimiento y el método para determinar Peróxidos en distintas muestras
Materiales:
Soporte
Universal
Pinzas
de nuez
Pinzas
para Bureta
Bureta
Pipeta
Agitador
2
Matraces Erlenmeyer
Vaso
de Precipitado
Matraz
Volumétrico
Vidrio
de Reloj
Piceta
Espátula
Perilla
Balanza
Granataria
Sustancias:
KMnO4 (Permanganato
de Potasio)
Na2C2O4
(Oxalato de Calcio)
Diferentes Muestras de Agua Oxigenada
Agua
Procedimiento:
1.- Cálculos para obtener la solución 0.01 N de KMnO4 (Permanganato de potasio)
en 100ml; y para valorarlo una solución de Na2C2O4
en 100 ml a la misma concentración (0.01 N)
2.-
Preparar
las soluciones y valorar el KMnO4
- Una vez obtenida la cantidad a pesar
tanto del Permanganato de Potasio como, calibrar la balanza granataria y pesar
sobre el vidrio de reloj, aforar con agua a 100ml en el matraz volumétrico,
mezclar constantemente hasta que se disuelva completamente y reservar.
- Realizar el procedimiento anterior con el Oxalato de Calcio (pesar,
aforar a 100ml y mezclar y reservar).
-Colocar la solución de permanganato de Potasio en la Bureta (previamente
montada en el soporte universal con las pinzas doble nuez y pinzas para
bureta).
-Tomar con la Pipeta 10ml de la solución de Oxalato de Sodio y colocarlo en
un matraz Erlenmeyer y debajo de la bureta.
----------------------------------------------------------------------------------------------------------------------------------
TO BE CONTINUED
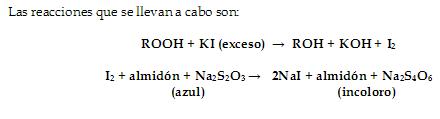











Gracias equipo!!! Falto la práctica de Determinación de nitritos
ResponderEliminar